ISO 13485 2016-Paket
2024-10-28 11:05ISO 13485 2016 Paket
Holen Sie sich Ihre Akkreditierung zu den geringstmöglichen Kosten


ISO/IEC 13845:2016 Gesamtpaket
Fassung 2016
Preis : 489 $
Das komplette ISO 17034 2016-Paket ist ein umfassendes Dokumentenpaket, das alle Vorlagen für Verfahren, Prozesse, Formulare, Checklisten, Werkzeuge, detaillierte Leitfäden und Anleitungen enthält, die für die Umsetzung benötigt werden:
- Starten Sie Ihren ISO/IEC 13485-Prozess.
- Erstellen Sie Ihre ISO/IEC 13485-Dokumentation.
- Schneller Zugang zur ISO/IEC 13485-Akkreditierung.
- Profitieren Sie von einem ISO/IEC 13485 Managementsystem, das einfach und an die Bedürfnisse Ihrer Organisation angepasst ist.

Warum mit einer leeren Seite beginnen? Starten Sie Ihr Projekt HEUTE und sparen Sie bis zu 80% an Zeit und Geld.

Dieses Paket beinhaltet eine einstündige Live 1-to-1 Online-Sitzung mit einem ISO-Berater, Dokumentenprüfungen, kontinuierlichen E-Mail-Support für 12 Monate und einen regelmäßigen Update-Service.

Kosteneffiziente Implementierung: Viel billiger als ein Berater vor Ort und viel weniger zeitaufwendig als eine Neuentwicklung
ISO/IEC 13845 2016 Version Komplettpaket
- Zusätzlicher Wert: Alle Anforderungen der ISO/IEC 13485 2016 wurden zu einem effizienten Prozess entwickelt, der einen Mehrwert für Ihr Unternehmen darstellt und somit die Produktivität erhöht.
- Wirksam: Es ist nur ein minimaler Aufwand erforderlich, um die Verfahren zu befolgen, die zur Erfüllung aller Anforderungen der ISO/IEC 13485 2016 erforderlich sind.
- Vereinfacht: Bürokratie und übermäßiger Papierkram wurden aus jedem Prozess entfernt, um ihn zu vereinfachen - und das bei voller Einhaltung der ISO/IEC 13485 2016.
Starten Sie Ihr Projekt HEUTEund sparen Sie bis zu 80% an Zeit und Geld.
Das umfassende Dokumentenpaket für die ISO/IEC 13845 Version 2016
Sparen Sie Zeit und Geld und vereinfachen Sie das Akkreditierungsverfahren.
Dokumente enthalten:

Formulare
👉 Dieses Paket bietet Ihnen die folgenden Funktionen:
- Vollständig Lebensdauer Zugang
- Zugriff auf einem Laptop, Desktop und Handy
Bescheinigung über den Abschluss
Dieses Paket enthält
Verfahren:
- Qualitätshandbuch
- Dokumentenkontrollverfahren
- Aufzeichnungskontrollverfahren
- Management-Review-Verfahren
- Internes Auditverfahren
- Korrekturmaßnahmenverfahren
- Verfahren für vorbeugende Maßnahmen
- Risikomanagementverfahren
- Entwurfs- und Entwicklungsverfahren
- Verfahren für den Einkauf
- Verfahren zur Lieferantenbewertung
- Verfahren der Eingangsprüfung
- Verfahren der Produktionskontrolle
- Kalibrierungsverfahren
- Verfahren zur Wartung
- Ausbildung Verfahren
- Verfahren für nichtkonforme Produkte
- Beschwerdebearbeitungsverfahren
- Verfahren der Beratungsanzeige
- Regulatorisches Meldeverfahren
- CAPA-Verfahren

Handbuch und Qualitätspolitik
- Qualitätshandbuch

SOPs
- SOP für die Wartung des Qualitätssystems
- SOP für Änderungsmanagement
- SOP für Etikettierung und Verpackung
- SOP für Produktlagerung und -verteilung
- SOP für Rückverfolgbarkeit
- SOP für Validierungs- und Verifizierungsaktivitäten
- SOP für Installation und Instandhaltung
- SOP für die Kontrolle des Sterilisationsprozesses (falls zutreffend)
- SOP für Reinraumverfahren (falls zutreffend)
- SOP für Software-Validierung (falls zutreffend)
- SOP für die Überwachung nach dem Inverkehrbringen
- SOP für die Meldung von Medizinprodukten
- SOP für Cybersecurity Management (falls zutreffend)
- SOP für Umweltüberwachung (falls zutreffend)
- SOP für Produktrückgabe und Rückruf
Umfassender Leitfaden zur ISO 13485:2016: Kapitel-für-Kapitel-Aufschlüsselung für das Qualitätsmanagement von Medizinprodukten
Kapitel 1: Anwendungsbereich
Dieses Kapitel definiert den Anwendungsbereich und den Zweck der ISO 13485:2016 und konzentriert sich auf die Notwendigkeit eines Qualitätsmanagementsystems für Medizinprodukte.
Wichtige Anforderungen:
- Anwendbarkeit: Die ISO 13485 gilt für Organisationen jeder Größe, die sich mit dem Design, der Entwicklung, der Produktion, der Installation und der Wartung von Medizinprodukten sowie den damit verbundenen Dienstleistungen befassen.
- Regulatorische Anforderungen: Die Norm unterstreicht, wie wichtig es ist, die geltenden gesetzlichen Anforderungen in allen Ländern zu erfüllen, in denen die Geräte verkauft werden.
- Ausschlüsse: Einige Design- und Entwicklungsanforderungen können aus dem Anwendungsbereich ausgeschlossen werden, wenn sie für die Aktivitäten der Organisation nicht relevant sind (z. B. Unternehmen, die keine Designaktivitäten durchführen).
Kapitel 2: Normative Verweise
In diesem Kapitel werden weitere Dokumente aufgeführt, auf die in der ISO 13485:2016 verwiesen wird und die für die Umsetzung der Norm wichtig sind.
Wichtige Anforderungen:
- ISO 9001: Die ISO 13485 basiert zwar auf den Grundsätzen der ISO 9001, enthält aber zusätzliche Anforderungen speziell für die Medizinprodukteindustrie. Sie verweist nicht direkt auf die ISO 9001, nutzt aber deren Struktur und Ansatz.

Kapitel 3: Begriffe und Definitionen
Dieses Kapitel enthält Definitionen für die in der Norm verwendeten Begriffe, um ein gemeinsames Verständnis der Schlüsselkonzepte zu gewährleisten.
Wichtige Anforderungen:
- Klare Terminologie: Es werden Definitionen für Begriffe wie "Medizinprodukt", "Risikomanagement", "Produktrealisierung" und andere für die Medizinprodukteindustrie relevante Begriffe gegeben. Das Verständnis dieser Begriffe ist entscheidend für die effektive Anwendung der Norm.
Kapitel 4: Qualitätsmanagementsystem
Dieses Kapitel umreißt die grundlegenden Anforderungen an die Einrichtung, Dokumentation, Umsetzung und Aufrechterhaltung eines QMS für Medizinprodukte.
Wichtige Anforderungen:
- Dokumentiertes Qualitätssystem: Die Organisation muss ein dokumentiertes Qualitätsmanagementsystem einrichten, das alle Prozesse und Tätigkeiten im Zusammenhang mit Medizinprodukten abdeckt.
- Risikomanagement: Das Risikomanagement muss in das QMS integriert und während des gesamten Produktlebenszyklus angewandt werden, vom Entwurf bis zur Überwachung nach der Markteinführung.
- Kontrolle der Dokumentation: Unternehmen müssen Kontrollen einführen, um die ordnungsgemäße Erstellung, Überprüfung, Genehmigung und Verteilung der QMS-Dokumentation sicherzustellen.
- Verwaltung von Unterlagen: Es muss ein System zur Aufbewahrung und Pflege von Aufzeichnungen über alle QMS-Aktivitäten vorhanden sein, um die Einhaltung sowohl der Norm als auch der behördlichen Anforderungen nachzuweisen.
Kapitel 5: Verantwortung des Managements
In diesem Kapitel wird die Rolle der obersten Führungsebene bei der Einrichtung und Aufrechterhaltung eines wirksamen QMS für Medizinprodukte hervorgehoben.
Wichtige Anforderungen:
- Engagement für die Führung: Die oberste Leitung muss Führungsqualitäten und Engagement für die Entwicklung, Umsetzung und kontinuierliche Verbesserung des QMS zeigen.
- Kundenorientierung: Die Unternehmen müssen sicherstellen, dass die Kundenbedürfnisse und die gesetzlichen Anforderungen vollständig verstanden und erfüllt werden.
- Qualitätspolitik: Die Geschäftsleitung muss eine Qualitätspolitik festlegen und umsetzen, die mit der strategischen Ausrichtung des Unternehmens und den gesetzlichen Verpflichtungen übereinstimmt.
- Management Review: Regelmäßige Überprüfungen durch das Management sind erforderlich, um die Wirksamkeit des QMS zu bewerten, verbesserungswürdige Bereiche zu ermitteln und sicherzustellen, dass es die gesetzlichen Anforderungen erfüllt.
Kapitel 6: Ressourcenmanagement
Dieses Kapitel befasst sich mit den für die Einführung und Aufrechterhaltung des QMS erforderlichen Ressourcen, einschließlich Personal, Infrastruktur und Arbeitsumgebung.
Wichtige Anforderungen:
- Kompetenz und Ausbildung: Die Mitarbeiter müssen für ihre Aufgabe, die Produktqualität und -sicherheit zu gewährleisten, kompetent und geschult sein. Dazu gehört auch, dass sie über die notwendige Ausbildung, Schulung und Erfahrung verfügen.
- Infrastruktur: Organisationen müssen die notwendige Infrastruktur (Gebäude, Arbeitsbereiche, Versorgungseinrichtungen und Ausrüstung) bereitstellen und unterhalten, um die Einhaltung des QMS zu gewährleisten.
- Arbeitsumfeld: Das Arbeitsumfeld muss kontrolliert werden, um die Produktsicherheit zu gewährleisten. Dazu gehört das Management von Bedingungen wie Sauberkeit, Kontaminationskontrolle und Umweltkontrollen, sofern erforderlich.
Kapitel 7: Produktrealisierung
In diesem Kapitel werden die Prozesse beschrieben, die für die Planung, Entwicklung und Herstellung von Medizinprodukten erforderlich sind, um sicherzustellen, dass sie sowohl die Anforderungen der Kunden als auch die der Behörden erfüllen.
Wichtige Anforderungen:
- Planung der Produktrealisierung: Unternehmen müssen Prozesse zur Planung und Steuerung des Produktrealisierungsprozesses vom Entwurf bis zur Auslieferung einrichten.
- Kundenbezogene Prozesse: Es muss einen klaren Prozess für das Verständnis und die Erfüllung der Kundenanforderungen geben, einschließlich Kommunikation, Auftragsabwicklung und Feedback.
- Design und Entwicklung: Für Unternehmen, die medizinische Geräte entwickeln, muss dieser Prozess kontrolliert, dokumentiert und überprüft werden, um zu gewährleisten, dass die Geräte sicher und wirksam sind und den gesetzlichen Vorschriften entsprechen.
- Einkaufskontrollen: Unternehmen müssen durch Lieferantenbewertung und -überwachung sicherstellen, dass alle eingekauften Materialien, Komponenten und Dienstleistungen den festgelegten Anforderungen entsprechen.
- Produktions- und Wartungskontrollen: Die Produktionsprozesse müssen kontrolliert werden, um sicherzustellen, dass die Medizinprodukte konsistent hergestellt werden und den Sicherheits- und Regulierungsanforderungen entsprechen. Dazu gehören die Validierung kritischer Prozesse (z. B. Sterilisation) und die Überprüfung der Produktspezifikationen.
- Rückverfolgbarkeit und Identifizierung: Unternehmen müssen Systeme zur Produktidentifizierung und Rückverfolgbarkeit einführen, insbesondere für kritische Komponenten und Materialien.
- Post-Market Surveillance: Nach der Markteinführung von Produkten müssen Unternehmen die Produktleistung überwachen, Feedback einholen, Beschwerden analysieren und gegebenenfalls Rückrufe durchführen.
Kapitel 8: Messung, Analyse und Verbesserung
In diesem Kapitel geht es um die Messung der Leistung des QMS und die Gewährleistung einer kontinuierlichen Verbesserung durch Datenanalyse und Korrekturmaßnahmen.
Wichtige Anforderungen:
- Überwachung und Messung: Unternehmen müssen die Wirksamkeit von Prozessen, Produkten und des QMS selbst messen und überwachen. Dazu gehören interne Audits, Kundenfeedback und Leistungsmetriken.
- Kontrolle von nicht konformen Produkten: Es müssen Verfahren vorhanden sein, um fehlerhafte Produkte zu identifizieren, zu kontrollieren und zu verwalten. Dazu gehören die Dokumentation der Nichtkonformität und die Durchführung von Korrekturmaßnahmen.
- Korrigierende und präventive Maßnahmen: Die Organisation muss Korrekturmaßnahmen ergreifen, um Nichtkonformitäten zu beheben und ihr erneutes Auftreten zu verhindern. Vorbeugende Maßnahmen müssen ergriffen werden, um mögliche Ursachen für Nichtkonformität zu beseitigen.
- Ständige Verbesserung: Die Organisationen müssen die Wirksamkeit des QMS durch die Analyse von Daten, Audits, Managementprüfungen und Kundenfeedback kontinuierlich verbessern.
90 Tage Geld-zurück-Garantie

Wenn Sie aus irgendeinem Grund innerhalb der ERSTEN 90 Tage nach Ihrem Kauf nicht zufrieden sind, wenden Sie sich einfach an support@qse-academy.com und unser Support-Team wird Ihnen sofort eine vollständige Rückerstattung zukommen lassen.
Das Paket enthält alle Dokumente, die Sie benötigen, um die ISO/IEC 13845 2016 zu erfüllen - diese Dokumente sind für das Akkreditierungsaudit voll akzeptabel.
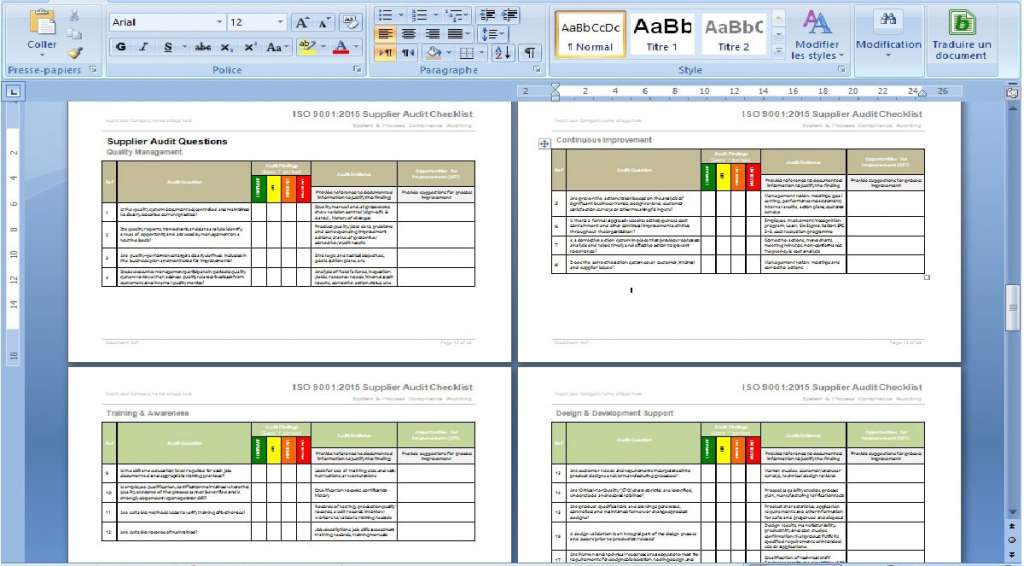
Alle Dokumente liegen in MS Word oder MS Excel vor, so dass sie sehr einfach an Ihr Unternehmen angepasst werden können. Sie können sie anpassen, indem Sie Firmenlogos und Farben hinzufügen und Kopf- und Fußzeilen bearbeiten, um sie an Ihren bevorzugten Stil anzupassen.

Wir haben bereits etwa 90% der in den Dokumenten geforderten Informationen ausgefüllt. Um sie auszufüllen, müssen Sie nur den Namen des Unternehmens, die verantwortlichen Personen und alle anderen Informationen, die für Ihr Unternehmen typisch sind, angeben. Sie werden durch den Prozess geführt, wobei die Elemente, die benötigt werden, und die, die optional sind, kommentiert werden.
Wir haben die ISO 13845-Dokumentation vorgelegt, um allen Anwendern die Gewissheit zu geben, dass sie alles genau und mit größtmöglicher Effizienz ausgefüllt haben.

Alle Dokumente sind so gestaltet, dass Sie die vorgeschlagene Reihenfolge perfekt nachvollziehen können. So können Sie sicherstellen, dass nichts fehlt und niemand verloren geht.
Die beigefügten Kommentare und Flussdiagramme helfen Ihren Mitarbeitern, jedes Dokument und seinen Nutzen zu verstehen, was Ihnen hilft, das Qualitätsmanagement flüssiger und die Prozesse einfacher zu gestalten.
Merkmale des kompletten ISO/IEC 13845 2016 Kits
Preis: 489 $
- Enthaltene Dokumentation: 58 Dokumente zur Umsetzung der ISO 13845
- MS Office 2007-Format, MS Office 2010, MS Office 2013
- Sprache: Englisch
- Die Dokumente sind vollständig bearbeitbar - geben Sie einfach die für Ihr Unternehmen spezifischen Informationen ein.
- Akzeptabel für das Akkreditierungsaudit nach ISO 13845 2016? Ja, alle von der ISO 13845 2016 geforderten Dokumente sind enthalten, ebenso wie die Qualitätspolitik und die aktuellen, aber optionalen Verfahren.
Sofortige Lieferung - Das Paket ist sofort nach dem Kauf herunterladbar
Kostenlose Beratung - Darüber hinaus können Sie zwei vollständige Unterlagen zur Prüfung durch Fachleute einreichen.
Erstellt für Ihr Unternehmen - Die Modelle sind für kleine und mittlere Unternehmen optimiert.


Vollständiges ISO/IEC 13845 2016-Paket
Der komplette Bausatz zur Umsetzung der ISO/IEC 13845
Preis : 489 $
Gesamtdauer der Umsetzung: 8 Monate
ISO/IEC 13845 Einführungsprojektplan
Das Erreichen der ISO 17020 ist ein wichtiger Meilenstein für jede Organisation und bedeutet eine Verpflichtung zum Datenschutz und zur Wahrung der Privatsphäre. Unsere fachkundigen Berater begleiten Sie durch jeden Schritt des Implementierungsprozesses, von der ersten Beratung und Lückenanalyse bis hin zur abschließenden Bewertung und Zertifizierung der Konformität. Mit unserem umfassenden Projektplan, maßgeschneiderten Schulungsprogrammen und engagiertem Support stellen wir sicher, dass Ihre Organisation alle Anforderungen der ISO 17020 effizient und effektiv erfüllt. Arbeiten Sie mit uns zusammen, um die Glaubwürdigkeit Ihres Unternehmens zu erhöhen, die Datenverarbeitungsprozesse zu verbessern und Vertrauen auf internationaler Ebene zu gewinnen. Lassen Sie uns Ihnen helfen, ein hervorragendes Datenschutzmanagement zu erreichen.
Einleitung: Projektauftakt und Lückenanalyse (Dauer: 1 Monat)
Einführende Aufgaben
1.1 ISO 13485-Einführung und Sensibilisierung
Aufgabe: Organisation eines Kick-off-Meetings
- Beschreibung: Führen Sie ein Kick-off-Meeting durch, um das ISO 13485:2016-Projekt den wichtigsten Interessengruppen vorzustellen und Ziele, Umfang, Zeitplan und Verantwortlichkeiten zu besprechen.
- Liefergegenstände: Projektplan, Tagesordnung und Sitzungsprotokolle.
- Treffen: Erste Konsultation mit der Geschäftsleitung und dem Implementierungsteam.
1.2 Lückenanalyse durchführen
Aufgabe: Durchführung einer Lückenanalyse gegen die Anforderungen der ISO 13485:2016
- Beschreibung: Bewertung des aktuellen QMS und der Prozesse der Organisation anhand der Anforderungen der ISO 13485:2016, um Lücken zu identifizieren.
- Liefergegenstände: Bericht über die Lückenanalyse mit den festgestellten Nichtkonformitäten.
- Treffen: Überprüfung der Ergebnisse mit dem Management und dem Qualitätsteam.
Abschnitt 1: Qualitätsmanagementsystem (QMS) Planung (Dauer: 2 Monate)
2.1 Entwicklung und Dokumentation von Qualitätspolitik und -zielen
Aufgabe: Definition von Qualitätspolitik und -zielen
- Beschreibung: Entwicklung einer Qualitätspolitik und messbarer Qualitätsziele, die sich an der ISO 13485:2016 und der strategischen Ausrichtung des Unternehmens orientieren.
- Liefergegenstände: Dokumentierte Qualitätspolitik und -ziele.
- Treffen: Überprüfung mit der Geschäftsleitung zur Genehmigung.
2.2 Entwicklung der QMS-Dokumentation
Aufgabe: Erstellen von QMS-Dokumentation (Verfahren, Arbeitsanweisungen)
- Beschreibung: Dokumentieren Sie alle von ISO 13485 geforderten Schlüsselprozesse, einschließlich Produktion, Design, Risikomanagement, Dokumentenkontrolle und Schulung.
- Liefergegenstände: QMS-Handbuch, Verfahren, Arbeitsanweisungen.
- Treffen: Überprüfung der dokumentierten Verfahren mit dem QMS-Team.
Abschnitt 2: Risikomanagement und Einhaltung gesetzlicher Vorschriften (Dauer: 2 Monate)
3.1 Implementierung von Risikomanagement-Prozessen (ISO 14971 Integration)
Aufgabe: Identifizierung und Dokumentation von Risikomanagement-Verfahren
- Beschreibung: Entwicklung und Umsetzung von Risikomanagementverfahren auf der Grundlage von ISO 14971 (Anwendung des Risikomanagements auf Medizinprodukte), um die Identifizierung, Analyse und Kontrolle von Risiken im Zusammenhang mit Medizinprodukten sicherzustellen.
- Liefergegenstände: Risikomanagementplan und -verfahren.
- Treffen: Überprüfung des Risikomanagementplans mit den Entwurfs- und Produktionsteams.
3.2 Sicherstellung der Einhaltung gesetzlicher Vorschriften (ISO 13485, Abschnitt 7.2)
Aufgabe: Definieren Sie regulatorische Anforderungen für Medizinprodukte
- Beschreibung: Identifizierung aller anwendbaren regulatorischen Anforderungen in Bezug auf Medizinprodukte in den relevanten Märkten (z. B. FDA, CE-Kennzeichnung) und Sicherstellung, dass diese in das QMS integriert werden.
- Liefergegenstände: Matrix für die Einhaltung von Rechtsvorschriften.
- Treffen: Überprüfung der rechtlichen Anforderungen mit den Teams für regulatorische Angelegenheiten und Qualitätssicherung.
Abschnitt 3: Produktrealisierung und Designkontrollen (Dauer: 1 Monat)
4.1 Einführung von Produktdesign- und Entwicklungsprozessen (ISO 13485 Klausel 7.3)
Aufgabe: Entwicklung von Design- und Entwicklungsprozeduren
- Beschreibung: Festlegung von Verfahren für den Entwurf und die Entwicklung von Medizinprodukten, einschließlich Entwurfsplanung, Inputs, Outputs, Verifizierung, Validierung und Entwurfsprüfungen.
- Liefergegenstände: Entwurfs- und Entwicklungsverfahren, Vorlagen für die Entwurfsprüfung.
- Treffen: Überprüfung mit Technik- und Designteams.
4.2 Implementierung von Design Change Controls
Aufgabe: Etablierung eines Design Change Management Prozesses
- Beschreibung: Erstellen Sie einen Prozess zur Kontrolle von Konstruktionsänderungen, um sicherzustellen, dass alle Änderungen dokumentiert, validiert und auf ihre Auswirkungen auf die Produktsicherheit, Leistung und Einhaltung gesetzlicher Vorschriften überprüft werden.
- Liefergegenstände: Verfahren zur Kontrolle von Konstruktionsänderungen.
- Treffen: Überprüfung mit Design-, Produktions- und Qualitätsteams.
Abschnitt 4: Lieferantenmanagement und Rückverfolgbarkeit (Dauer: 1 Monat)
5.1 Lieferantenbewertung und -zulassung (ISO 13485, Abschnitt 7.4)
Aufgabe: Entwicklung von Verfahren zur Lieferantenbewertung
- Beschreibung: Einführung eines Bewertungs- und Genehmigungsverfahrens für Lieferanten, um sicherzustellen, dass diese die erforderlichen Qualitätsstandards und gesetzlichen Anforderungen erfüllen.
- Liefergegenstände: Bewertungskriterien für Lieferanten, Liste der zugelassenen Lieferanten.
- Treffen: Überprüfung der Leistungsdaten und Genehmigungskriterien der Lieferanten mit der Beschaffung.
5.2 Rückverfolgbarkeit und Kontrolle von Medizinprodukten umsetzen
Aufgabe: Entwicklung von Rückverfolgbarkeitsverfahren (ISO 13485, Abschnitt 7.5)
- Beschreibung: Einrichtung eines Rückverfolgbarkeitssystems, um sicherzustellen, dass der Werdegang, die Anwendung und der Standort von Medizinprodukten während der gesamten Produktion, Lieferung und Installation zurückverfolgt werden können.
- Liefergegenstände: Rückverfolgbarkeitsverfahren, Rückverfolgbarkeitsaufzeichnungen.
- Treffen: Schulung des Personals in den Rückverfolgbarkeitsverfahren und Durchführung von Systemtests.
Abschnitt 5: Kontrolle nicht konformer Produkte und Korrekturmaßnahmen (Dauer: 1 Monat)
6.1 Kontrolle nicht konformer Produkte (ISO 13485, Abschnitt 8.3)
Aufgabe: Festlegung von Verfahren für den Umgang mit fehlerhaften Produkten
- Beschreibung: Entwicklung von Verfahren zur Identifizierung, Dokumentation, Aussonderung und Entsorgung von nicht konformen Produkten, um sicherzustellen, dass diese nicht zu Kunden oder Patienten gelangen.
- Liefergegenstände: Berichte über Nichtkonformitäten, Protokolle über Abhilfemaßnahmen.
- Treffen: Überprüfung der Verfahren bei Nichtkonformität mit den Produktions- und Qualitätsteams.
6.2 Umsetzung von Korrektur- und Vorbeugungsmaßnahmen (ISO 13485, Abschnitt 8.5)
Aufgabe: Entwicklung von Verfahren für Abhilfemaßnahmen
- Beschreibung: Einführung eines Verfahrens für Korrektur- und Vorbeugungsmaßnahmen (CAPA), um die Ursache von Nichtkonformitäten zu untersuchen und Vorbeugungsmaßnahmen zu ergreifen, um ein erneutes Auftreten zu vermeiden.
- Liefergegenstände: CAPA-Berichte, Dokumentation der Ursachenanalyse.
- Treffen: CAPA-Besprechung mit der Geschäftsleitung und den Abteilungsleitern.
Abschnitt 6: Interne Audits und Managementprüfung (Dauer: 2 Monate)
7.1 Internes Auditprogramm (ISO 13485, Abschnitt 8.2.4)
Aufgabe: Entwicklung eines internen Auditplans
- Beschreibung: Erstellung eines internen Auditprogramms zur Bewertung der Effektivität des QMS, das alle von der ISO 13485:2016 geforderten Bereiche abdeckt, einschließlich Entwicklung, Produktion, Lieferantenmanagement und Einhaltung von Vorschriften.
- Liefergegenstände: Interner Auditplan, Audit-Checkliste.
- Treffen: Auditplanungssitzung mit dem Auditteam und dem Qualitätsmanager.
7.2 Interne Audits durchführen
Aufgabe: Interne Audits durchführen
- Beschreibung: Durchführung interner Audits zur Überprüfung der Einhaltung des QMS und der Anforderungen der ISO 13485. Ermittlung aller Nichtkonformitäten und verbesserungswürdiger Bereiche.
- Liefergegenstände: Interne Auditberichte, Berichte über Nichtkonformität.
- Treffen: Nachbesprechung mit dem Managementteam zur Erörterung der Feststellungen und Abhilfemaßnahmen.
7.3 Durchführung der Managementprüfung (ISO 13485, Abschnitt 5.6)
Aufgabe: Planen und Durchführen eines Management Reviews
- Beschreibung: Durchführung einer Managementbewertung, um die Wirksamkeit des QMS und seine Ausrichtung auf die Unternehmensziele zu beurteilen. Sicherstellen, dass die oberste Leitung die Leistung des QMS und Verbesserungsmöglichkeiten bewertet.
- Liefergegenstände: Sitzungsprotokolle der Managementbewertung, Aktionspläne.
- Treffen: Präsentation der Ergebnisse und Diskussion strategischer Verbesserungsmaßnahmen mit der Geschäftsleitung.
Abschließende Bewertung: Vorbereitung der Zertifizierung und externes Audit (Dauer: 1 Monat)
8.1 Vorzertifizierungsaudit
Aufgabe: Durchführung eines internen Audits vor der Zertifizierung
- Beschreibung: Durchführung eines Vorzertifizierungsaudits, um zu überprüfen, ob das QMS die Anforderungen der ISO 17034:2016 erfüllt und für das Zertifizierungsaudit bereit ist. Beseitigen Sie alle verbleibenden Nichtkonformitäten.
- Liefergegenstände: Vorzertifizierungs-Auditbericht, Pläne für Abhilfemaßnahmen.
- Treffen: Abschließende Überprüfung mit der Geschäftsleitung zur Bestätigung der Bereitschaft für die externe Prüfung.
8.2 Auswahl der Zertifizierungsstelle und externes Audit
Aufgabe: Auswahl der Zertifizierungsstelle und Planung des Zertifizierungsaudits
- Beschreibung: Auswahl einer akkreditierten Zertifizierungsstelle für das ISO 13485-Audit. Koordinieren Sie den Zeitplan für das externe Audit und stellen Sie sicher, dass die Organisation vollständig vorbereitet ist.
- Liefergegenstände: Bericht über die Auswahl der Zertifizierungsstelle, Zeitplan für das externe Audit.
- Treffen: Abschlusssitzung mit dem Management und dem Qualitätsteam, um die Bereitschaft für das Zertifizierungsaudit zu bestätigen.
Dieser 8-monatige Projektplan für Umsetzung der ISO 13485:2016 bietet einen strukturierten Ansatz zur Erlangung der Zertifizierung. Der Plan deckt die Schlüsselbereiche Qualitätsmanagement, Risikomanagement, Design- und Entwicklungskontrollen, Lieferantenmanagement, Umgang mit Nichtkonformität und interne Audits ab und gipfelt im abschließenden Zertifizierungsaudit.
Was unsere Kunden denken:
"Wir waren anfangs überwältigt von dem Gedanken, die ISO 13485-Zertifizierung zu erhalten, aber das Paket der QSE-Akademie machte alles so viel einfacher. Die Dokumente waren gut organisiert, und etwa 90% der Arbeit wurde bereits für uns erledigt! Wir mussten nur noch kleinere Details anpassen, was unserem Team viel Zeit und Mühe erspart hat. Besonders geschätzt haben wir die 1-on-1-Online-Sitzung mit dem ISO-Experten, die uns bei der Bewältigung schwieriger Teile der Akkreditierung geholfen hat. Mit diesem Paket haben wir sowohl Zeit als auch Geld gespart, verglichen mit der Beauftragung externer Berater."
Sarah M.
Compliance Manager
"Die Umsetzung der ISO 13485 schien zunächst eine gewaltige Aufgabe zu sein, aber das Paket der QSE Academy hat uns sehr geholfen. Es hat nicht nur den gesamten Prozess mit vorgefertigten Vorlagen und Richtlinien gestrafft, sondern uns auch erhebliche Kosten erspart, da wir keine Vollzeitberater mehr benötigen. Der Support war fantastisch, und wir konnten das Projekt in einem Bruchteil der ursprünglich veranschlagten Zeit abschließen. Ich kann es jedem empfehlen, der nach einer kostengünstigen Möglichkeit der Akkreditierung sucht!"
James K.
Direktor der Operation
Häufig gestellte Fragen
Wie lange dauert es, bis ich das vollständige Paket mit den Dokumenten nach meiner Bestellung erhalte?
Nach Abschluss des Kaufs werden Sie sofort zur Download-Seite weitergeleitet. Außerdem wird Ihnen ein Link für den Zugriff auf Ihre Datei per E-Mail zugesandt. Die Dateien werden im .zip-Format bereitgestellt, das Sie entpacken müssen. Sollten Sie Probleme mit dem Download haben, zögern Sie bitte nicht, uns zu kontaktieren unter support@qse-academy.com. Unser Support-Team ist immer bereit, Sie zu unterstützen.
Welche Zahlungsmittel kann ich verwenden?
Wir bieten Ihnen mehrere Zahlungsmöglichkeiten an, damit Sie bequem bezahlen können. Sie können mit einer Kreditkarte, einer Debitkarte oder PayPal bezahlen. Außerdem bieten wir ein flexibles Ratenzahlungsprogramm für diejenigen an, die ihren Einkauf lieber in Raten bezahlen möchten. Wenn Sie Fragen zu unseren Zahlungsmöglichkeiten haben, zögern Sie bitte nicht, uns zu kontaktieren.
Bieten Sie eine Geld-zurück-Garantie an, wenn ich mit dem Service nicht zufrieden bin?
Wir bieten eine 30-tägige Geld-zurück-Garantie. Wenn Sie aus irgendeinem Grund mit unserem Service nicht zufrieden sind, können Sie innerhalb der ersten 30 Tage kündigen und erhalten eine volle Rückerstattung, ohne Fragen zu stellen.
Wie kann ich mit dem ISO-Experten kommunizieren?
Wenn Sie einen Kauf tätigen, werden Sie von einem Kundenbetreuer kontaktiert, der Sie während des gesamten Prozesses unterstützt. Unsere Terminplanung ist flexibel, um Ihren Bedürfnissen gerecht zu werden. Wenn Sie einen Termin beantragen, erhalten Sie einen Link, über den Sie den für Sie günstigsten Termin auswählen können. Außerdem können Sie mit dem ISO-Experten per E-Mail kommunizieren.






