ISO 15189 2022-Paket
2024-11-05 13:42ISO 15189 2022 Paket
Holen Sie sich Ihre Akkreditierung zu den geringstmöglichen Kosten


ISO 15189 2022 Komplettpaket
Version 2022
Preis : 389 $
Das Gesamtpaket ISO/IEC 17025 2017 ist ein umfassendes Dokumentenpaket, das alle Vorlagen für Verfahren, Prozesse, Formulare, Checklisten, Werkzeuge, detaillierte Leitfäden und Anleitungen enthält, die für die Umsetzung benötigt werden:
- Starten Sie Ihren ISO 15189 2022-Prozess.
- Erstellen Sie Ihre ISO 15189 2022 Dokumentation.
- Schneller Zugang zur Akkreditierung nach ISO 15189 2022.
- Profitieren Sie von einem ISO 15189 2022 Managementsystem, das einfach und an die Bedürfnisse Ihrer Organisation angepasst ist.

Warum mit einer leeren Seite beginnen? Starten Sie Ihr Projekt HEUTE und sparen Sie bis zu 80% an Zeit und Geld.

Dieses Paket beinhaltet eine einstündige Live 1-to-1 Online-Sitzung mit einem ISO-Berater, Dokumentenprüfungen, kontinuierlichen E-Mail-Support für 12 Monate und einen regelmäßigen Update-Service.

Kosteneffiziente Implementierung: Viel billiger als ein Berater vor Ort und viel weniger zeitaufwendig als eine Neuentwicklung
ISO 15189 2022 Version Komplettpaket
- Zusätzlicher Wert: Alle ISO 15189 2022 Die Anforderungen wurden zu einem effizienten Prozess entwickelt. Das fügt hinzu operativer Wert für Ihr Labor und erhöht folglich die Produktivität.
- Wirksam: Minimaler Aufwand ist erforderlich die erforderlichen Verfahren zu befolgen alle Anforderungen der ISO-Norm zu erfüllen 15189 2022 Version.
- Vereinfacht: Bürokratie und übermäßiger Papierkram wurden aus allen Prozessen entfernt, um sie zu vereinfachen - und das bei voller Einhaltung der ISO-Normen.
Starten Sie Ihr Projekt HEUTEund sparen Sie bis zu 80% an Zeit und Geld.
Das umfassende Dokumentenpaket für die ISO 15189 Version 2022
Sparen Sie Zeit und Geld und vereinfachen Sie das Akkreditierungsverfahren.
Dokumente enthalten:

Verfahren
- Qualitätshandbuch
- Dokumentenkontrollverfahren
- Aufzeichnungskontrollverfahren
- Internes Auditverfahren
- Korrekturmaßnahmenverfahren
- Verfahren für vorbeugende Maßnahmen
- Kontrolle von fehlerhaftem Output Verfahren
- Management-Review-Verfahren
- Kompetenz-, Schulungs- und Sensibilisierungsverfahren
- Gerätekalibrierung und Wartungsverfahren
- Einkaufs- und Lieferantenbewertungsverfahren
- Verfahren für den Empfang und die Handhabung von Proben
- Präanalytisches Verfahren
- Analytisches Verfahren
- Post-analytisches Verfahren
- Berichterstattung über die Ergebnisse Verfahren
- Qualitätsindikatoren und Überwachungsverfahren
- Verfahren für Kundenbeschwerden
- Verfahren für Vertraulichkeit und Informationssicherheit
- Sicherheitsverfahren im Labor
- Abfallbewirtschaftungsverfahren
Aufzeichnungen und Formulare:
- Formular zur Genehmigung des Qualitätshandbuchs
- Antragsformular für Dokumentänderungen
- Formular Ausbildungsnachweis
- Berichtsformular für das interne Audit
- Antragsformular für Korrekturmaßnahmen
- Antragsformular für vorbeugende Maßnahmen
- Formular für den Bericht über Nichtkonformität
- Sitzungsprotokoll der Managementbewertung
- Gerätekalibrierungs- und Wartungsaufzeichnungen
- Lieferantenbewertungs- und Genehmigungsformular
- Muster eines Empfangs- und Abfertigungsprotokolls
- Testergebnis-Protokoll
- Protokoll zur Überwachung der Qualitätsindikatoren
- Kundenbeschwerdeprotokoll

Handbuch und Qualitätspolitik
- ISO 15189 Qualitätshandbuch
Andere:
- Qualitätspolitik des Labors
- Umfang der Akkreditierung des Labors
- Organigramm
- Berufsbeschreibungen

SOPs
- SOP für Dokumentenlenkung
- SOP für die Aufzeichnungskontrolle
- SOP für interne Audits
- SOP für Korrekturmaßnahmen
- SOP für Präventivmaßnahmen
- SOP für die Kontrolle von fehlerhaften Ergebnissen
- SOP für Management Review
- SOP für Kompetenz, Schulung und Sensibilisierung
- SOP für Gerätekalibrierung und -wartung
- SOP für Einkauf und Lieferantenbewertung
- SOP für die Entgegennahme und Handhabung von Proben
- SOP für prä-analytische Prozesse
- SOP für analytische Prozesse
- SOP für post-analytische Prozesse
- SOP für die Berichterstattung über die Ergebnisse
- SOP für Qualitätsindikatoren und Überwachung
- SOP für Kundenreklamationen
- SOP für Vertraulichkeit und Informationssicherheit
- SOP für Laborsicherheit
- SOP für Abfallmanagement
Umfassende Aufschlüsselung der ISO 15189 2022: Kapitel-für-Kapitel-Leitfaden für Qualität und Kompetenz im medizinischen Labor
Kapitel 1: Anwendungsbereich
Dieses Kapitel definiert den Anwendungsbereich und die Anwendbarkeit der ISO 15189 2022, wobei der Schwerpunkt auf den Qualitäts- und Kompetenzanforderungen für medizinische Laboratorien liegt.
Wichtige Anforderungen:
- Anwendbarkeit: Die ISO 15189 gilt für medizinische Laboratorien, die klinische Tests durchführen, und enthält Leitlinien für die Verwaltung von Laborqualitätssystemen und die Gewährleistung der Genauigkeit und Zuverlässigkeit der Patientenergebnisse.
- Kompetenz und Qualität: Die Norm enthält Anforderungen an Qualitätsmanagementsysteme (QMS) und an die fachliche Kompetenz medizinischer Laboratorien sowohl in Bezug auf Management als auch auf technische Aspekte.
- Einhaltung von Vorschriften: Die Laboratorien müssen sicherstellen, dass sie neben den ISO 15189-Normen auch die geltenden Vorschriften und gesetzlichen Bestimmungen erfüllen.
Kapitel 2: Normative Verweise
Dieses Kapitel beschreibt die anderen Dokumente und Normen, auf die in der ISO 15189 2022 verwiesen wird und die für das Verständnis und die Umsetzung der Anforderungen notwendig sind.
Wichtige Anforderungen:
- Referenzierte Normen: Die ISO 15189 greift auf einschlägige ISO-Normen wie ISO 9001 für das Qualitätsmanagement und ISO/IEC 17025 für Prüf- und Kalibrierlaboratorien zurück und gewährleistet so die Konsistenz der Qualitätsrahmen.

Kapitel 3: Begriffe und Definitionen
Dieses Kapitel enthält Definitionen von Schlüsselbegriffen, die in der gesamten Norm verwendet werden, um ein gemeinsames Verständnis der Kernkonzepte zu gewährleisten.
Wichtige Anforderungen:
- Wichtige Terminologie: In diesem Abschnitt werden Begriffe wie "Laborleiter", "Prüfung", "Qualitätsindikator" und "Nichtkonformität" geklärt. Diese Begriffe sind von grundlegender Bedeutung, um sicherzustellen, dass alle Anwender der Norm diese einheitlich und korrekt auslegen.
Kapitel 4: Anforderungen an die Verwaltung
Dieses Kapitel befasst sich mit den Anforderungen an das Qualitätsmanagementsystem (QMS), das medizinische Laboratorien einführen müssen, um qualitativ hochwertige Dienstleistungen und zuverlässige Patientenergebnisse zu gewährleisten.
Wichtige Anforderungen:
- Qualitätsmanagement-System: Laboratorien müssen ein QMS einrichten, umsetzen und aufrechterhalten, das alle Aspekte ihrer Tätigkeit abdeckt. Dieses System sollte dokumentiert werden, um sicherzustellen, dass alle Prozesse und Verfahren zur Gewährleistung der Qualität vorhanden sind.
- Engagement für die Führung: Die Laborleitung ist für die Wirksamkeit des QMS verantwortlich, einschließlich der Festlegung einer Qualitätspolitik, der Festlegung messbarer Qualitätsziele und der Gewährleistung der Verfügbarkeit von Ressourcen.
- Risikomanagement: Laboratorien müssen über einen Risikomanagementrahmen verfügen, der potenzielle Risiken für die Qualität und die Patientensicherheit berücksichtigt, einschließlich der Identifizierung, Bewertung und Kontrolle dieser Risiken.
- Dokumenten- und Aufzeichnungskontrolle: Dokumentenkontrollverfahren müssen sicherstellen, dass alle relevanten Informationen, einschließlich Richtlinien, Verfahren und Aufzeichnungen, ordnungsgemäß verwaltet werden, zugänglich sind und regelmäßig überprüft werden, um die Richtigkeit und Einhaltung der Vorschriften zu gewährleisten.
Kapitel 5: Ressourcenmanagement
Dieses Kapitel befasst sich mit den Ressourcen, die medizinische Laboratorien benötigen, um das Qualitätsmanagementsystem einzuführen und aufrechtzuerhalten und um Laboraufgaben kompetent durchzuführen.
Wichtige Anforderungen:
- Kompetenz und Ausbildung des Personals: Die Labormitarbeiter müssen kompetent sein und über eine für ihre Aufgaben relevante Ausbildung, Schulung und Erfahrung verfügen. Kontinuierliche Schulungsprogramme müssen sicherstellen, dass die Fähigkeiten des Personals auf dem neuesten Stand bleiben.
- Einrichtungen und Umweltbedingungen: Die Laboratorien müssen angemessene Einrichtungen und Umweltbedingungen bereitstellen und aufrechterhalten, um eine Kontamination oder Verschlechterung der Proben zu verhindern und genaue Ergebnisse zu gewährleisten.
- Verwaltung der Ausrüstung: Alle Geräte müssen ordnungsgemäß gewartet, kalibriert und validiert werden, um ihre Zuverlässigkeit zu gewährleisten. Die Laboratorien müssen Verfahren für die routinemäßige Wartung und für Abhilfemaßnahmen bei Fehlfunktionen der Geräte festlegen.
- Beschaffungs- und Lieferantenmanagement: Die Laboratorien müssen die Lieferungen von Reagenzien und Verbrauchsmaterialien verwalten und sicherstellen, dass sie den Qualitätsanforderungen entsprechen. Zugelassene Lieferanten sollten auf die Einhaltung der Qualitätsanforderungen geprüft und überwacht werden.
Kapitel 6: Prozessanforderungen
Dieses Kapitel befasst sich mit den technischen Abläufen des Labors, einschließlich der Voruntersuchung, der Untersuchung und der Nachuntersuchung.
Wichtige Anforderungen:
- Prozesse vor der Prüfung: Laboratorien müssen über definierte Prozesse für die Probenentnahme, den Transport und die Handhabung verfügen, um die Integrität der Proben zu gewährleisten. Dazu gehört eine klare Kommunikation mit Patienten, Klinikern und Probenentnahmestellen.
- Prüfungsvorgänge: Alle Labortests müssen validiert, standardisiert und dokumentiert werden, um sicherzustellen, dass die Verfahren den gesetzlichen Anforderungen entsprechen und genaue, zuverlässige Ergebnisse liefern.
- Nachprüfungsprozesse: Die Laboratorien müssen sicherstellen, dass die Ergebnisse überprüft und rechtzeitig gemeldet werden, wobei Mechanismen zur Überprüfung und gegebenenfalls Änderung der Berichte vorhanden sein müssen. Die Berichte müssen genau, sicher und vertraulich sein.
- Labor-Informationssysteme: Gegebenenfalls müssen die Laboratorien robuste Informationsmanagementsysteme einführen und pflegen, um Patientendaten, Testergebnisse und Berichte sicher zu handhaben.
Kapitel 7: Kontinuierliche Verbesserung
In diesem Kapitel geht es darum, dass die Laboratorien ihre Prozesse, ihr Qualitätsmanagementsystem und ihre Leistung regelmäßig überwachen und verbessern müssen.
Wichtige Anforderungen:
- Interne Audits: Die Laboratorien müssen regelmäßig interne Audits ihres QMS und ihrer technischen Abläufe durchführen, um verbesserungswürdige Bereiche zu ermitteln. Die Feststellungen sollten dokumentiert werden, und es sollten Abhilfemaßnahmen folgen.
- Qualitätsindikatoren: Laboratorien müssen wichtige Leistungsindikatoren festlegen, um die Prozessleistung und die Qualitätsergebnisse zu überwachen. Diese Indikatoren helfen bei der Bewertung der Kundenzufriedenheit, der Testgenauigkeit und der Pünktlichkeit der Dienstleistungen.
- Korrigierende und präventive Maßnahmen: Nichtkonformitäten müssen durch dokumentierte Korrekturmaßnahmen behoben werden, während vorbeugende Maßnahmen ergriffen werden müssen, um zukünftige Nichtkonformitäten zu vermeiden.
- Management Review: Regelmäßige Überprüfungen des QMS durch das Management sollten die Leistung des Laboratoriums, die Qualitätsziele und die Möglichkeiten zur Verbesserung bewerten.
Kapitel 8: Risikomanagement und Patientensicherheit
Dieses neue Kapitel der ISO 15189 2022 legt den Schwerpunkt auf Risikomanagement und Patientensicherheit und trägt damit dem kritischen Charakter medizinischer Labortests im Gesundheitswesen Rechnung.
Wichtige Anforderungen:
- Identifizierung und Kontrolle von Risiken: Laboratorien müssen systematisch Risiken im Zusammenhang mit Labortätigkeiten, -prozessen und -dienstleistungen ermitteln, die sich auf die Patientensicherheit und die Testqualität auswirken könnten.
- Proaktives Risikomanagement: Es müssen Verfahren zur proaktiven Risikobewertung eingeführt werden, um sicherzustellen, dass potenzielle Probleme angegangen werden, bevor sie die Patientensicherheit oder die Genauigkeit der Ergebnisse beeinträchtigen.
- Meldung von Vorfällen: Laboratorien sollten über Systeme zur Identifizierung, Meldung und Analyse von Zwischenfällen oder unerwünschten Ereignissen verfügen und Korrekturmaßnahmen ergreifen, um eine Wiederholung zu verhindern.

30 Tage Geld-zurück-Garantie
Wenn Sie aus irgendeinem Grund innerhalb der ERSTEN 90 Tage nach Ihrem Kauf nicht zufrieden sind, wenden Sie sich einfach an support@qse-academy.com und unser Support-Team wird Ihnen sofort eine vollständige Rückerstattung zukommen lassen.
Das Paket enthält alle Dokumente, die Sie benötigen, um die ISO 15189 2022 zu erfüllen - diese Dokumente werden bei der Akkreditierungsprüfung voll akzeptiert.
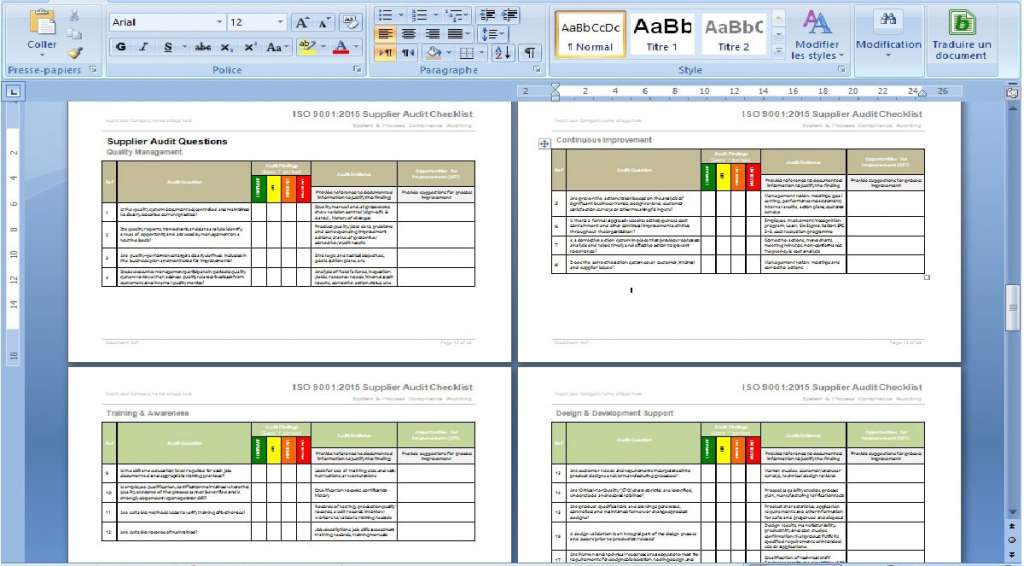
Alle Dokumente liegen in MS Word oder MS Excel vor, so dass sie sehr einfach an Ihr Unternehmen angepasst werden können. Sie können sie anpassen, indem Sie Firmenlogos und Farben hinzufügen und Kopf- und Fußzeilen bearbeiten, um sie an Ihren bevorzugten Stil anzupassen.

Wir haben bereits etwa 90% der in den Dokumenten geforderten Informationen ausgefüllt. Um sie auszufüllen, müssen Sie nur den Namen des Unternehmens, die verantwortlichen Personen und alle anderen Informationen, die für Ihr Unternehmen typisch sind, angeben. Sie werden durch den Prozess geführt, wobei die Elemente, die benötigt werden, und die, die optional sind, kommentiert werden.
Wir haben die ISO 17025-Dokumentation vorgelegt, um allen Anwendern die Gewissheit zu geben, dass sie alles genau und mit größtmöglicher Effizienz ausgefüllt haben.

Alle Dokumente sind so gestaltet, dass Sie die vorgeschlagene Reihenfolge perfekt nachvollziehen können. So können Sie sicherstellen, dass nichts fehlt und niemand verloren geht.
Die beigefügten Kommentare und Flussdiagramme helfen Ihren Mitarbeitern, jedes Dokument und seinen Nutzen zu verstehen, was Ihnen hilft, das Qualitätsmanagement flüssiger und die Prozesse einfacher zu gestalten.
Merkmale des kompletten ISO 15189 2022 Kits
Preis: 389 $
- Enthaltene Dokumentation: 58 Dokumente zur Umsetzung der ISO 15189
- Sprache: Englisch
- Die Dokumente sind vollständig bearbeitbar - geben Sie einfach die für Ihr Unternehmen spezifischen Informationen ein.
- Sind sie für das Akkreditierungsaudit nach ISO 15189 2022 geeignet? Ja, alle von der ISO 15189 2022 geforderten Dokumente sind enthalten, ebenso wie die Qualitätspolitik und die aktuellen, aber fakultativen Verfahren.
Sofortige Lieferung - Das Paket ist sofort nach dem Kauf herunterladbar
Kostenlose Beratung - Darüber hinaus können Sie zwei vollständige Unterlagen zur Prüfung durch Fachleute einreichen.
Erstellt für Ihr Unternehmen - Die Modelle sind für kleine und mittlere Unternehmen optimiert.


Vollständiges ISO 15189 2022-Paket
Das komplette Set zur Umsetzung der ISO 15189
Preis : 389 $
ISO 15189 2022 Projektplan zur Umsetzung
Das Erreichen der ISO 17020 ist ein wichtiger Meilenstein für jede Organisation und bedeutet eine Verpflichtung zum Datenschutz und zur Wahrung der Privatsphäre. Unsere fachkundigen Berater begleiten Sie durch jeden Schritt des Implementierungsprozesses, von der ersten Beratung und Lückenanalyse bis hin zur abschließenden Bewertung und Zertifizierung der Konformität. Mit unserem umfassenden Projektplan, maßgeschneiderten Schulungsprogrammen und engagiertem Support stellen wir sicher, dass Ihre Organisation alle Anforderungen der ISO 17020 effizient und effektiv erfüllt. Arbeiten Sie mit uns zusammen, um die Glaubwürdigkeit Ihres Unternehmens zu erhöhen, die Datenverarbeitungsprozesse zu verbessern und Vertrauen auf internationaler Ebene zu gewinnen. Lassen Sie uns Ihnen helfen, ein hervorragendes Datenschutzmanagement zu erreichen.
Einleitung: Projektauftakt und Lückenanalyse
Einführende Aufgaben
1.1 ISO 15189 Startschuss und Sensibilisierung
Aufgabe: Organisation eines Kick-off-Meetings
- Beschreibung: Halten Sie ein Kick-off-Meeting ab, um das ISO 15189-Projekt vorzustellen und den Hauptbeteiligten die Ziele, den Umfang, den Zeitplan und den Ressourcenbedarf zu erläutern.
- Liefergegenstände: Projektplan, Tagesordnung und Sitzungsprotokolle.
- Treffen: Erste Konsultation mit der Geschäftsleitung und dem Implementierungsteam.
1.2 Lückenanalyse durchführen
Aufgabe: Durchführung einer Lückenanalyse gegen die Anforderungen der ISO 15189 2012
- Beschreibung: Bewertung der aktuellen Laborprozesse, des Managementsystems und der technischen Abläufe anhand der Anforderungen der ISO 15189:2012, um Lücken zu ermitteln.
- Liefergegenstände: Bericht über die Lückenanalyse mit den festgestellten Nichtkonformitäten.
- Treffen: Besprechung der Ergebnisse mit der Geschäftsleitung, den Laborleitern und den Qualitätsteams.
Abschnitt 1: QMS-Dokumentation und Qualitätspolitik
2.1 Entwicklung und Dokumentation von Qualitätspolitik und -zielen
Aufgabe: Definition von Qualitätspolitik und -zielen
- Beschreibung: Festlegung der Qualitätspolitik des Labors und messbarer Qualitätsziele, die mit der ISO 15189:2012 und der strategischen Ausrichtung des Unternehmens in Einklang gebracht werden.
- Liefergegenstände: Dokumentierte Qualitätspolitik und -ziele.
- Treffen: Überprüfung und Freigabe mit der Geschäftsleitung.
2.2 Entwicklung der Dokumentation des Qualitätsmanagementsystems
Aufgabe: Erstellen von QMS-Dokumentation (Verfahren, Arbeitsanweisungen)
- Beschreibung: Erarbeitung der erforderlichen Dokumentation für das Qualitätsmanagementsystem, einschließlich eines Qualitätshandbuchs, von Prozessverfahren und Arbeitsanweisungen, die den Anforderungen der ISO 15189 entsprechen.
- Liefergegenstände: Qualitätshandbuch, Verfahren, Arbeitsanweisungen.
- Treffen: Überprüfung der Dokumentation mit dem QMS-Team.
Abschnitt 2: Laborbetrieb und Risikomanagement
3.1 Einführung von Laborbetriebsverfahren (ISO 15189 Abschnitte 5.4, 5.5, 5.6)
Aufgabe: Festlegung von Verfahren für den Laborbetrieb
- Beschreibung: Dokumentieren und implementieren Sie Verfahren für die Voruntersuchung (Probenentnahme), die Untersuchung (Testen) und die Nachuntersuchung (Berichterstattung) der Laborarbeit und stellen Sie dabei die Einhaltung der ISO 15189:2012 sicher.
- Liefergegenstände: Standardarbeitsanweisungen (SOPs) für den Laborbetrieb.
- Treffen: Überprüfung und Validierung der Verfahren mit dem Laborpersonal und den technischen Teams.
3.2 Risikomanagement-Verfahren entwickeln
Aufgabe: Implementierung von Risikomanagement in Labortätigkeiten
- Beschreibung: Entwicklung von Verfahren zur Identifizierung, Bewertung und Kontrolle von Risiken im Zusammenhang mit Labortätigkeiten, einschließlich Risiken für die Patientensicherheit und Fehlfunktionen von Geräten.
- Liefergegenstände: Risikomanagementplan und -verfahren.
- Treffen: Überprüfung des Risikomanagementprozesses mit dem technischen und dem Qualitätsteam.
Abschnitt 3: Kompetenz und Ausbildung
4.1 Kompetenz des Laborpersonals (ISO 15189, Abschnitt 5.1)
Aufgabe: Definition von Kompetenzanforderungen für Laborpersonal
- Beschreibung: Festlegung von Kriterien für die Kompetenz des Laborpersonals, einschließlich der für jede Funktion im Labor erforderlichen Qualifikationen, Fähigkeiten und Schulungen.
- Liefergegenstände: Kompetenzmatrix und Stellenbeschreibungen.
- Treffen: Überprüfung mit der Personalabteilung und den Abteilungsleitern, um die Rollen und Kompetenzanforderungen an das Personal festzulegen.
4.2 Entwicklung eines Schulungs- und Kompetenzbewertungsprogramms
Aufgabe: Erstellen und Implementieren eines Schulungsprogramms
- Beschreibung: Entwicklung eines Schulungsprogramms, das sicherstellt, dass alle Labormitarbeiter für die ihnen zugewiesenen Aufgaben kompetent sind, und Einführung von Verfahren zur fortlaufenden Kompetenzbewertung.
- Liefergegenstände: Unterlagen zum Schulungsprogramm und Aufzeichnungen über abgeschlossene Schulungen.
- Treffen: Schulungen mit dem Personal zu neuen Verfahren und Bewertungen.
Abschnitt 4: Geräteverwaltung und Rückverfolgbarkeit
5.1 Ausrüstungsverwaltung (ISO 15189, Abschnitt 5.3)
Aufgabe: Einführung von Verfahren zur Kalibrierung und Wartung der Ausrüstung
- Beschreibung: Festlegung von Verfahren für die Kalibrierung, Wartung und Qualifizierung von Laborgeräten zur Gewährleistung von Genauigkeit und Zuverlässigkeit.
- Liefergegenstände: Verfahren zur Verwaltung der Ausrüstung, Kalibrierungsplan, Wartungsprotokolle.
- Treffen: Überprüfung und Umsetzung des Ausrüstungsmanagements zusammen mit dem technischen Team.
5.2 Sicherstellung der Rückverfolgbarkeit von Messergebnissen
Aufgabe: Entwicklung und Implementierung von Rückverfolgbarkeitssystemen
- Beschreibung: Sicherstellung der Rückverfolgbarkeit aller Messergebnisse, von der Probenahme bis zum Abschlussbericht, um die Zuverlässigkeit und Reproduzierbarkeit der Testergebnisse zu gewährleisten.
- Liefergegenstände: Rückverfolgbarkeitsverfahren und Aufzeichnungen.
- Treffen: Überprüfung der Rückverfolgbarkeitssysteme mit den Labor- und Qualitätsteams.
Abschnitt 5: Dokumentenlenkung und fehlerhafte Arbeit
6.1 Einführung eines Dokumentenlenkungssystems (ISO 15189, Abschnitt 4.3)
Aufgabe: Festlegung von Verfahren für die Dokumentenkontrolle
- Beschreibung: Entwicklung eines Dokumentenkontrollsystems zur Verwaltung aller QMS-bezogenen Unterlagen, um sicherzustellen, dass alle Dokumente regelmäßig überprüft, genehmigt und aktualisiert werden.
- Liefergegenstände: Dokumentenkontrollverfahren, Dokumentenregister.
- Treffen: Schulung des Personals in Bezug auf das Dokumentenkontrollsystem.
6.2 Nichtkonforme Arbeit und Korrekturmaßnahmen (ISO 15189, Abschnitt 4.9)
Aufgabe: Festlegung von Verfahren für den Umgang mit fehlerhafter Arbeit
- Beschreibung: Implementierung eines Prozesses zur Identifizierung, Dokumentation und Behebung von fehlerhaften Arbeiten (z. B. fehlerhafte Testergebnisse), um sicherzustellen, dass geeignete Korrekturmaßnahmen ergriffen werden, um eine Wiederholung zu verhindern.
- Liefergegenstände: Berichte über Nichtkonformitäten, Protokolle über Abhilfemaßnahmen.
- Treffen: Überprüfung nach dem Audit, um nicht konforme Arbeit und Korrekturmaßnahmen zu besprechen.
Abschnitt 6: Interne Audits und kontinuierliche Verbesserung
7.1 Entwicklung eines internen Auditprogramms (ISO 15189, Abschnitt 4.14)
Aufgabe: Erstellen eines internen Auditplans
- Beschreibung: Einrichtung eines internen Auditprogramms zur Bewertung der Wirksamkeit des QMS, das alle kritischen Laborprozesse und die Anforderungen der ISO 15189 abdeckt.
- Liefergegenstände: Interner Auditplan, Audit-Checkliste.
- Treffen: Überprüfung des Auditplans mit dem Auditteam und dem Qualitätsmanager.
7.2 Interne Audits durchführen
Aufgabe: Interne Audits durchführen
- Beschreibung: Durchführung von internen Audits zur Überprüfung der Einhaltung der Anforderungen der ISO 17034 und des QMS. Identifizierung von verbesserungswürdigen Bereichen und Durchführung von Korrekturmaßnahmen.
- Liefergegenstände: Interne Auditberichte, Berichte über Nichtkonformität.
- Treffen: Nachbesprechung mit dem Managementteam zur Erörterung der Feststellungen und Abhilfemaßnahmen.
Abschließende Bewertung: Vorbereitung der Zertifizierung und externes Audit
8.1 Durchführung eines internen Audits vor der Zertifikation
Aufgabe: Durchführung eines internen Audits vor der Zertifizierung
- Beschreibung: Durchführung eines vollständigen internen Audits, um die Bereitschaft des Labors für das Akkreditierungsaudit nach ISO 15189 zu bewerten und sicherzustellen, dass alle festgestellten Mängel behoben wurden.
- Liefergegenstände: Vorzertifizierungs-Auditbericht.
- Treffen: Besprechung der Prüfungsfeststellungen mit der Geschäftsleitung und Festlegung von Abhilfemaßnahmen.
8.2 Auswahl der Zertifizierungsstelle und externes Audit
Aufgabe: Auswahl der Zertifizierungsstelle und Planung des Zertifizierungsaudits
- Beschreibung: Recherche und Auswahl einer akkreditierten Zertifizierungsstelle für ISO 15189. Planen Sie das externe Audit und stellen Sie sicher, dass das Labor vollständig vorbereitet ist.
- Liefergegenstände: Bericht über die Auswahl der Zertifizierungsstelle, Zeitplan für das externe Audit.
- Treffen: Abschlusssitzung mit dem Management und dem Qualitätsteam, um die Bereitschaft für das Zertifizierungsaudit zu bestätigen.
Dieser 8-monatige Projektplan für Umsetzung der ISO 15189:2012 gewährleistet einen strukturierten Ansatz zur Erlangung der Akkreditierung für medizinische Laboratorien. Es deckt alle wichtigen Bereiche ab, einschließlich Qualitätsmanagement, Laborbetrieb, Gerätemanagement, Umgang mit Abweichungen, interne Audits und Vorbereitung auf die Zertifizierung, um die Einhaltung der ISO 15189 am Ende des Projekts zu gewährleisten.
Was unsere Kunden denken:
Schritte zur Erfüllung der ISO 15189 - Die Erfahrung unseres Labors "Unser Labor hatte viele Schwierigkeiten bei der Vorbereitung auf die Akkreditierung nach den in IS0 15189 genannten Richtlinien. Zum Glück hilft das leicht verständliche Paket der QSE-Akademie, dieses Verfahren zu vereinfachen. Die Dokumente waren sehr professionell, gut organisiert und leicht auf unsere eigene Situation zuzuschneiden - das hat uns eine Menge Zeit gespart! Außerdem konnten wir durch die 1:1-Sitzung sicherstellen, dass wir in jeder Situation so konform wie möglich waren. Auf ein besseres Jahr 2018, in dem wir mit Volldampf auf dem Weg zur Akkreditierung voranschreiten und unser Team das Vertrauen hat, weiterhin auf höchstem Niveau zu arbeiten.
Rachel Thompson
Laborleiter
Nachdem wir gehört hatten, wie gut sie anderen Labors bei der Erlangung der ISO 15189-Akkreditierung geholfen hatten, entschieden wir uns für die QSE Academy. Sie verfügten über ein sehr umfassendes Toolkit und einen schrittweisen Prozess, der es uns ermöglichte, den Implementierungsaufwand zu reduzieren. Die Vorlagen waren äußerst praktisch und die fachkundigen Beratungsgespräche beantworteten alle unsere Fragen. Dank der QSE Academy ist unser Labor effizienter geworden und wir sind bereit für die Akkreditierung. Wir sind froh, dass wir diese Investition getätigt haben.
Michael Perez
Qualitätsmanager
Häufig gestellte Fragen
Wie lange dauert es, bis ich das vollständige Paket mit den Dokumenten nach meiner Bestellung erhalte?
Nach Abschluss des Kaufs werden Sie sofort zur Download-Seite weitergeleitet. Außerdem wird Ihnen ein Link für den Zugriff auf Ihre Datei per E-Mail zugesandt. Die Dateien werden im .zip-Format bereitgestellt, das Sie entpacken müssen. Sollten Sie Probleme mit dem Download haben, zögern Sie bitte nicht, uns zu kontaktieren unter support@qse-academy.com. Unser Support-Team ist immer bereit, Sie zu unterstützen.
Welche Zahlungsmittel kann ich verwenden?
Wir bieten Ihnen mehrere Zahlungsmöglichkeiten an, damit Sie bequem bezahlen können. Sie können mit einer Kreditkarte, einer Debitkarte oder PayPal bezahlen. Außerdem bieten wir ein flexibles Ratenzahlungsprogramm für diejenigen an, die ihren Einkauf lieber in Raten bezahlen möchten. Wenn Sie Fragen zu unseren Zahlungsmöglichkeiten haben, zögern Sie bitte nicht, uns zu kontaktieren.
Bieten Sie eine Geld-zurück-Garantie an, wenn ich mit dem Service nicht zufrieden bin?
Wir bieten eine 30-tägige Geld-zurück-Garantie. Wenn Sie aus irgendeinem Grund mit unserem Service nicht zufrieden sind, können Sie innerhalb der ersten 30 Tage kündigen und erhalten eine volle Rückerstattung, ohne Fragen zu stellen.
Wie kann ich mit dem ISO-Experten kommunizieren?
Wenn Sie einen Kauf tätigen, werden Sie von einem Kundenbetreuer kontaktiert, der Sie während des gesamten Prozesses unterstützt. Unsere Terminplanung ist flexibel, um Ihren Bedürfnissen gerecht zu werden. Wenn Sie einen Termin beantragen, erhalten Sie einen Link, über den Sie den für Sie günstigsten Termin auswählen können. Außerdem können Sie mit dem ISO-Experten per E-Mail kommunizieren.







