ISO 13485 2016-paket
2024-10-28 11:05ISO 13485 2016 Package
Få din ackreditering till lägsta möjliga kostnad


ISO/IEC 13845:2016 komplett paket
2016 års version
Pris : 489 $
Det kompletta ISO 17034 2016-paketet är ett omfattande dokumentpaket som innehåller allt från alla mallar för procedurer, processer, formulär, checklistor, verktyg, detaljerade guider och instruktioner som behövs för att:
- Starta din ISO/IEC 13485-process.
- Skapa din ISO/IEC 13485-dokumentation.
- Snabb åtkomst till ISO/IEC 13485-ackreditering.
- Dra nytta av ett ISO/IEC 13485-ledningssystem som är enkelt och anpassat till din organisations behov.

Varför börja med en tom sida? Starta ditt projekt idag och spara upp till 80% i tid och pengar.

Paketet innehåller en timmes live 1-to-1 onlinesession med en ISO-konsult, dokumentgranskning, kontinuerlig e-postsupport i 12 månader och regelbunden uppdateringstjänst.

Kostnadseffektivt genomförande: Mycket billigare än en konsult på plats och kräver mycket mindre tid än att göra det från början.
ISO/IEC 13845 2016 Version Komplett paket
- Mervärde: Alla krav i ISO/IEC 13485 2016 har utvecklats till en effektiv process som ger mervärde till din organisation och därmed ökar produktiviteten.
- Effektivt: Minimal ansträngning krävs för att följa de procedurer som är nödvändiga för att uppfylla alla krav i ISO/IEC 13485 2016.
- Förenklad: Byråkrati och överdrivet pappersarbete har eliminerats från varje process för att göra det enkelt - samtidigt som det är helt i enlighet med ISO/IEC 13485 2016.
Starta ditt projekt idagoch spara upp till 80% på din tid och dina pengar.
Allt-i-ett-dokumentpaket för ISO/IEC 13845 2016 version
Spara tid, spara pengar och förenkla ackrediteringsprocessen.
Dokumenten ingår:

Blanketter
👉 Det här paketet ger dig följande funktioner:
- Fullständigt livstid tillgång till
- Åtkomst på en bärbar dator, stationär och mobil
Intyg om slutförandet
Detta paket innehåller
Förfaranden:
- Kvalitetshandbok
- Procedur för dokumentkontroll
- Procedur för registreringskontroll
- Ledningens granskningsprocedur
- Internrevisionsförfarande
- Procedur för korrigerande åtgärder
- Förebyggande åtgärder
- Riskhanteringsprocedur
- Förfarande för design och utveckling
- Inköpsförfarande
- Procedur för utvärdering av leverantörer
- Procedur för mottagningskontroll
- Förfarande för produktionsstyrning
- Kalibreringsprocedur
- Underhållsprocedur
- Förfarande för utbildning
- Procedur för avvikande produkt
- Procedur för hantering av klagomål
- Förfarande för rådgivande meddelande
- Förfarande för regelbunden rapportering
- CAPA-förfarande

Handbok och kvalitetspolicy
- Kvalitetshandbok

SOP:er
- SOP för underhåll av kvalitetssystem
- SOP för förändringsledning
- SOP för etikettering och förpackning
- SOP för lagring och distribution av produkter
- SOP för spårbarhet
- SOP för validerings- och verifieringsaktiviteter
- SOP för installation och service
- SOP för kontroll av steriliseringsprocessen (om tillämpligt)
- SOP för renrumsprocedurer (om tillämpligt)
- SOP för validering av programvara (om tillämpligt)
- SOP för övervakning efter marknadsintroduktion
- SOP för rapportering av medicintekniska produkter
- SOP för cybersäkerhetshantering (om tillämpligt)
- SOP för miljöövervakning (om tillämpligt)
- SOP för returnering och återkallande av produkter
Omfattande guide till ISO 13485:2016: Uppdelning kapitel för kapitel för kvalitetsstyrning av medicintekniska produkter
Kapitel 1: Omfattning
Detta kapitel definierar omfattningen av och syftet med ISO 13485:2016, med fokus på behovet av ett kvalitetsledningssystem för medicintekniska produkter.
Viktiga krav:
- Tillämplighet: ISO 13485 gäller för organisationer av alla storlekar som är involverade i design, utveckling, produktion, installation och service av medicintekniska produkter samt relaterade tjänster.
- Lagstadgade krav: Standarden betonar vikten av att uppfylla tillämpliga lagstadgade krav i varje jurisdiktion där produkterna säljs.
- Undantag: Vissa design- och utvecklingskrav kan uteslutas från tillämpningsområdet om de inte är relevanta för organisationens verksamhet (t.ex. företag som inte utför designaktiviteter).
Kapitel 2: Normativa referenser
I detta kapitel listas andra dokument som det hänvisas till i ISO 13485:2016 och som är viktiga för dess tillämpning.
Viktiga krav:
- ISO 9001: ISO 13485 bygger på principerna i ISO 9001, men innehåller ytterligare krav som är specifika för den medicintekniska industrin. Den hänvisar inte direkt till ISO 9001, men använder dess struktur och tillvägagångssätt.

Kapitel 3: Termer och definitioner
Detta kapitel innehåller definitioner av de termer som används i standarden för att säkerställa en gemensam förståelse av nyckelbegrepp.
Viktiga krav:
- Tydlig terminologi: Definitioner ges för termer som "medicinteknisk produkt", "riskhantering", "produktrealisering" och andra termer som är relevanta för den medicintekniska industrin. Att förstå dessa termer är avgörande för att kunna tillämpa standarden på ett effektivt sätt.
Kapitel 4: Kvalitetsledningssystem
I detta kapitel beskrivs de grundläggande kraven för att upprätta, dokumentera, implementera och underhålla ett QMS för medicintekniska produkter.
Viktiga krav:
- Dokumenterat kvalitetssystem: Organisationen måste upprätta ett dokumenterat kvalitetsledningssystem som omfattar alla processer och aktiviteter som rör medicintekniska produkter.
- Riskhantering: Riskhanteringen måste integreras i kvalitetsstyrningssystemet och tillämpas under hela produktens livscykel, från design till övervakning efter marknadsintroduktion.
- Kontroll av dokumentation: Organisationer måste implementera kontroller för att säkerställa korrekt skapande, granskning, godkännande och distribution av QMS-dokumentation.
- Dokumenthantering: Ett system måste finnas på plats för att bevara och upprätthålla register över alla QMS-aktiviteter för att visa överensstämmelse med både standarden och lagstadgade krav.
Kapitel 5: Ledningens ansvar
I detta kapitel betonas den högsta ledningens roll när det gäller att upprätta och upprätthålla ett effektivt QMS för medicintekniska produkter.
Viktiga krav:
- Ledarskapsengagemang: Högsta ledningen måste visa ledarskap och engagemang för utveckling, implementering och kontinuerlig förbättring av QMS.
- Kundfokus: Organisationerna måste säkerställa att kundernas behov och myndigheternas krav förstås och uppfylls fullt ut.
- Kvalitetspolicy: Ledningen måste definiera och implementera en kvalitetspolicy som är förenlig med organisationens strategiska inriktning och lagstadgade skyldigheter.
- Ledningens genomgång: Regelbundna ledningskontroller krävs för att utvärdera effektiviteten i QMS, identifiera områden för förbättring och säkerställa att det uppfyller lagstadgade krav.
Kapitel 6: Resurshantering
Detta kapitel behandlar de resurser som krävs för att införa och upprätthålla QMS, inklusive personal, infrastruktur och arbetsmiljö.
Viktiga krav:
- Kompetens och utbildning: Medarbetarna måste vara kompetenta och utbildade för sina roller när det gäller att säkerställa produktkvalitet och säkerhet. Detta innefattar att tillhandahålla nödvändig utbildning, träning och erfarenhet.
- Infrastruktur: Organisationer måste tillhandahålla och underhålla nödvändig infrastruktur (byggnader, arbetsutrymmen, verktyg och utrustning) för att säkerställa efterlevnad av QMS.
- Arbetsmiljö: Arbetsmiljön måste kontrolleras för att garantera produktsäkerheten. Detta inkluderar hantering av förhållanden som renlighet, kontamineringskontroll och miljökontroller där det behövs.
Kapitel 7: Produktrealisering
I detta kapitel beskrivs de processer som krävs för att planera, utveckla och producera medicintekniska produkter och säkerställa att de uppfyller både kundernas och myndigheternas krav.
Viktiga krav:
- Planering av produktrealisering: Organisationer måste etablera processer för att planera och kontrollera produktframtagningsprocessen, från design till leverans.
- Kundrelaterade processer: Det måste finnas en tydlig process för att förstå och uppfylla kundernas krav, inklusive kommunikation, orderhantering och återkoppling.
- Design och utveckling: För organisationer som konstruerar medicintekniska produkter måste denna process kontrolleras, dokumenteras och granskas för att säkerställa att produkterna är säkra, effektiva och uppfyller lagstadgade standarder.
- Kontroll av inköp: Organisationen måste säkerställa att alla inköpta material, komponenter och tjänster uppfyller specificerade krav genom utvärderingar och övervakning av leverantörer.
- Kontroll av produktion och service: Produktionsprocesserna måste kontrolleras för att säkerställa att medicintekniska produkter tillverkas på ett konsekvent sätt och uppfyller säkerhets- och myndighetskrav. Detta inkluderar validering av kritiska processer (t.ex. sterilisering) och verifiering av produktspecifikationer.
- Spårbarhet och identifiering: Organisationer måste implementera system för att identifiera produkter och upprätthålla spårbarhet, särskilt för kritiska komponenter och material.
- Övervakning efter marknadsintroduktion: När produkterna har släppts måste organisationerna övervaka produktprestandan, bland annat genom att samla in feedback, analysera klagomål och hantera återkallelser vid behov.
Kapitel 8: Mätning, analys och förbättring
Detta kapitel fokuserar på att mäta QMS-prestanda och säkerställa kontinuerlig förbättring genom dataanalys och korrigerande åtgärder.
Viktiga krav:
- Övervakning och mätning: Organisationer måste mäta och övervaka effektiviteten hos processer, produkter och själva QMS. Detta inkluderar interna revisioner, kundfeedback och prestationsmätningar.
- Kontroll av icke överensstämmande produkter: Det måste finnas rutiner för att identifiera, kontrollera och hantera produkter som inte uppfyller kraven. Detta inkluderar dokumentation av avvikelsen och säkerställande av att korrigerande åtgärder genomförs.
- Korrigerande och förebyggande åtgärder: Organisationen måste vidta korrigerande åtgärder för att åtgärda avvikelser och förhindra att de upprepas. Förebyggande åtgärder måste vidtas för att eliminera potentiella orsaker till avvikelser.
- Kontinuerlig förbättring: Organisationer måste kontinuerligt förbättra QMS effektivitet genom analys av data, revisioner, ledningens genomgångar och återkoppling från kunder.
90 dagars pengarna tillbaka-garanti

Om du av någon anledning under de första 90 dagarna efter köpet inte är nöjd av någon anledning, kan du helt enkelt kontakta support@qse-academy.com och vårt supportteam kommer att ge dig en omedelbar och fullständig återbetalning.
Paketet innehåller alla dokument som du behöver för att uppfylla ISO/IEC 13845 2016 - dessa dokument är fullt godtagbara vid ackrediteringsrevisionen.
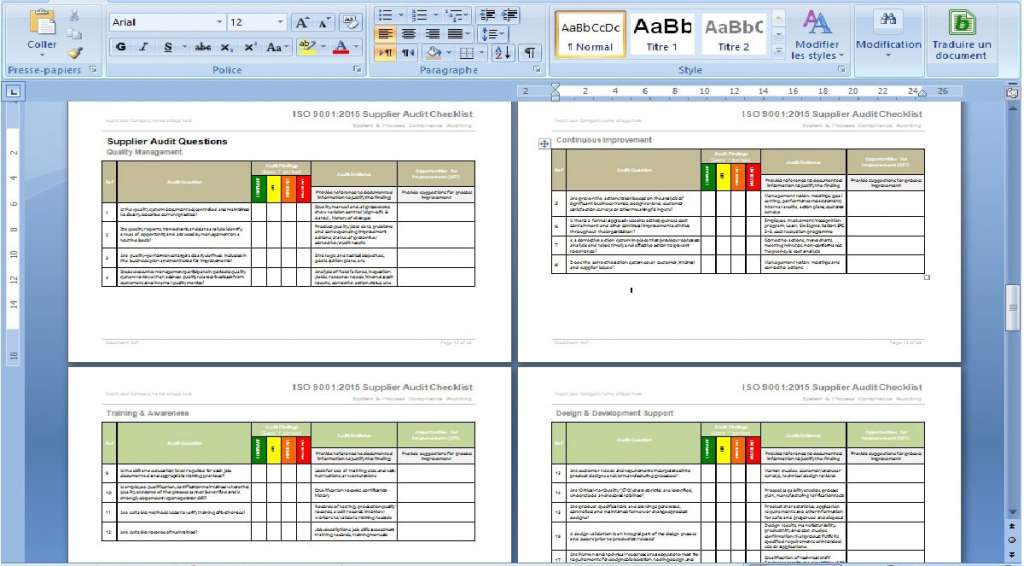
Alla dokument är i MS Word eller MS Excel, vilket gör det mycket enkelt att anpassa dem till ditt företag. Du kan anpassa dem genom att lägga till företagslogotyper och färger och redigera rubriker och sidfötter för att matcha din favoritstil.

Vi har redan fyllt i ungefär 90% av den information som begärs i dokumenten. För att fylla i dem behöver du bara fylla i företagets namn, de ansvariga parterna och annan information som är unik för ditt företag. du kommer att guidas genom processen och kommentera de delar som behövs och de som är frivilliga.
Vi presenterade ISO 17025-dokumentationen för att försäkra alla användare om att de har slutfört allting korrekt och med största möjliga effektivitet.

Alla dokument är gjorda så att du kan följa den föreslagna ordningen perfekt, vilket gör att du kan se till att inget saknas och att ingen går vilse i processen.
De medföljande kommentarerna och flödesschemana hjälper personalen att förstå varje dokument och dess användbarhet, vilket hjälper dig att göra kvalitetshanteringen smidigare och processerna lättare att följa.
Funktioner i det kompletta ISO/IEC 13845 2016-kitet
Pris: 489 $
- Dokumentation ingår: 58 dokument för implementering av ISO 13845
- MS Office 2007-format, MS Office 2010, MS Office 2013
- Språk: engelska engelska
- Dokumenten är helt redigerbara - ange bara den information som är specifik för ditt företag.
- Godtagbart för ackrediteringsrevisionen enligt ISO 13845 2016? Ja, alla dokument som krävs enligt ISO 13845 2016 ingår, liksom kvalitetspolicyn och de aktuella men valfria procedurerna.
Omedelbar leverans - Paketet kan laddas ner omedelbart efter köpet.
Gratis konsultation - Dessutom kan du skicka in två kompletta dokument för granskning av professionella experter.
Skapad för ditt företag - Modellerna är optimerade för små och medelstora företag.


Komplett paket för ISO/IEC 13845 2016
Det kompletta kitet för att implementera ISO/IEC 13845
Pris : 489 $
Total genomförandetid: 8 månader
Projektplan för implementering av ISO/IEC 13845
Att uppnå ISO 17020 är en viktig milstolpe för alla organisationer och innebär ett åtagande för dataskydd och integritet. Våra expertkonsulter finns här för att vägleda dig genom varje steg i implementeringsprocessen, från inledande konsultation och gapanalys till slutlig bedömning och certifiering av efterlevnad. Med vår omfattande projektplan, skräddarsydda utbildningsprogram och dedikerade support ser vi till att din organisation uppfyller alla ISO 17020-krav på ett effektivt sätt. Samarbeta med oss för att öka din organisations trovärdighet, förbättra datahanteringsprocesserna och vinna förtroende på internationell nivå. Låt oss hjälpa dig att uppnå excellens inom dataskyddshantering.
Introduktion: Projektstart och analys av brister (Varaktighet: 1 månad)
Inledande uppgifter
1.1 ISO 13485 Kick-off och medvetenhet
Uppgift: Organisera kick-off-möte
- Beskrivning: Genomför ett kick-off-möte för att presentera ISO 13485:2016-projektet för nyckelintressenter och diskutera mål, omfattning, tidsramar och ansvarsområden.
- Leveranser: Projektplan, mötesagenda och protokoll.
- Möte: Inledande samråd med högsta ledningen och implementeringsteamet.
1.2 Utföra Gap-analys
Uppgift: Genomföra gapanalys mot kraven i ISO 13485:2016
- Beskrivning: Utvärdera organisationens nuvarande QMS och processer mot kraven i ISO 13485:2016 för att identifiera luckor.
- Leveranser: Gap-analysrapport med identifierade avvikelser.
- Möte: Gå igenom resultaten med ledningen och kvalitetsteamet.
Avsnitt 1: Planering av kvalitetsledningssystem (QMS) (Varaktighet: 2 månader)
2.1 Utveckla och dokumentera kvalitetspolicy och kvalitetsmål
Uppgift: Definiera kvalitetspolicy och kvalitetsmål
- Beskrivning: Utveckla en kvalitetspolicy och mätbara kvalitetsmål som är i linje med ISO 13485:2016 och organisationens strategiska inriktning.
- Leveranser: Dokumenterad kvalitetspolicy och kvalitetsmål.
- Möte: Genomgång med högsta ledningen för godkännande.
2.2 Utveckla QMS-dokumentation
Uppgift: Skapa QMS-dokumentation (procedurer, arbetsinstruktioner)
- Beskrivning: Dokumentera alla viktiga processer som krävs enligt ISO 13485, inklusive produktion, design, riskhantering, dokumentkontroll och utbildning.
- Leveranser: QMS-manual, rutiner, arbetsinstruktioner.
- Möte: Gå igenom dokumenterade rutiner med QMS-teamet.
Avsnitt 2: Riskhantering och regelefterlevnad (Varaktighet: 2 månader)
3.1 Implementera riskhanteringsprocesser (ISO 14971-integration)
Uppgift: Identifiera och dokumentera riskhanteringsrutiner
- Beskrivning: Utveckla och implementera riskhanteringsrutiner baserade på ISO 14971 (Tillämpning av riskhantering på medicintekniska produkter) för att säkerställa identifiering, analys och kontroll av risker förknippade med medicintekniska produkter.
- Leveranser: Plan och förfarande för riskhantering.
- Möte: Gå igenom riskhanteringsplanen med design- och produktionsteamen.
3.2 Säkerställa efterlevnad av regelverk (ISO 13485, paragraf 7.2)
Uppgift: Definiera regulatoriska krav för medicintekniska produkter
- Beskrivning: Identifiera alla tillämpliga regulatoriska krav relaterade till medicintekniska produkter på relevanta marknader (t.ex. FDA, CE-märkning) och se till att de integreras i QMS.
- Leveranser: Matris för regelefterlevnad.
- Möte: Granska lagstadgade krav med teamen för regleringsfrågor och kvalitetssäkring.
Avsnitt 3: Produktrealisering och designkontroller (Varaktighet: 1 månad)
4.1 Etablera processer för produktdesign och produktutveckling (ISO 13485, paragraf 7.3)
Uppgift: Utveckla design- och utvecklingsprocedurer
- Beskrivning: Upprätta rutiner för konstruktion och utveckling av medicintekniska produkter, inklusive konstruktionsplanering, inmatning, utmatning, verifiering, validering och konstruktionsgranskning.
- Leveranser: Design- och utvecklingsförfarande, mallar för designgranskning.
- Möte: Granskning med teknik- och designteam.
4.2 Implementera kontroll av konstruktionsändringar
Uppgift: Etablera en process för hantering av designförändringar
- Beskrivning: Skapa en process för kontroll av konstruktionsändringar för att säkerställa att alla ändringar dokumenteras, valideras och granskas med avseende på deras inverkan på produktsäkerhet, prestanda och efterlevnad av regelverk.
- Leveranser: Procedur för kontroll av konstruktionsändringar.
- Möte: Granskning med design-, produktions- och kvalitetsteam.
Avsnitt 4: Leverantörshantering och spårbarhet (Varaktighet: 1 månad)
5.1 Utvärdering och godkännande av leverantörer (ISO 13485, paragraf 7.4)
Uppgift: Utveckla rutiner för utvärdering av leverantörer
- Beskrivning: Implementera en process för utvärdering och godkännande av leverantörer för att säkerställa att leverantörerna uppfyller de kvalitetsstandarder och myndighetskrav som krävs.
- Leveranser: Kriterier för utvärdering av leverantörer, lista över godkända leverantörer.
- Möte: Granska leverantörernas prestationer och kriterier för godkännande tillsammans med inköp.
5.2 Implementera spårbarhet och kontroll av medicintekniska produkter
Uppgift: Utveckla spårbarhetsprocedurer (ISO 13485 klausul 7.5)
- Beskrivning: Inrätta ett spårbarhetssystem för att säkerställa att medicintekniska produkters historia, användning och placering kan spåras genom hela produktions-, leverans- och installationsprocessen.
- Leveranser: Spårbarhetsförfarande, spårbarhetsregister.
- Möte: Utbilda personalen i spårbarhetsrutiner och genomföra systemtester.
Avsnitt 5: Kontroll av icke överensstämmande produkter och korrigerande åtgärder (Varaktighet: 1 månad)
6.1 Kontroll av icke överensstämmande produkt (ISO 13485 klausul 8.3)
Uppgift: Upprätta rutiner för hantering av produkter som inte uppfyller kraven
- Beskrivning: Utveckla rutiner för att identifiera, dokumentera, separera och kassera produkter som inte uppfyller kraven, för att säkerställa att de inte når kunder eller patienter.
- Leveranser: Avvikelserapporter, loggar över korrigerande åtgärder.
- Möte: Granska rutiner för avvikelser med produktions- och kvalitetsteam.
6.2 Implementera korrigerande och förebyggande åtgärder (ISO 13485 klausul 8.5)
Uppgift: Utveckla rutiner för korrigerande åtgärder
- Beskrivning: Implementera en process för korrigerande och förebyggande åtgärder (CAPA) för att undersöka grundorsaken till avvikelser och vidta förebyggande åtgärder för att undvika upprepning.
- Leveranser: CAPA-rapporter, dokumentation av grundorsaksanalys.
- Möte: CAPA-granskningsmöte med högsta ledningen och avdelningscheferna.
Avsnitt 6: Internrevision och ledningens genomgång (Varaktighet: 2 månader)
7.1 Program för internrevision (ISO 13485, paragraf 8.2.4)
Uppgift: Utveckla en plan för internrevision
- Beskrivning: Skapa ett internt revisionsprogram för att utvärdera effektiviteten i QMS, som täcker alla områden som krävs enligt ISO 13485:2016, inklusive design, produktion, leverantörshantering och efterlevnad av regler.
- Leveranser: Intern revisionsplan, checklista för revision.
- Möte: Planeringsmöte för revisionen med revisionsteamet och kvalitetschefen.
7.2 Genomföra interna revisioner
Uppgift: Utföra internrevisioner
- Beskrivning: Genomföra interna revisioner för att kontrollera att kraven i QMS och ISO 13485 uppfylls. Identifiera eventuella avvikelser och områden för förbättring.
- Leveranser: Interna revisionsrapporter, rapporter om avvikelser.
- Möte: Granskningsmöte efter revisionen med ledningsgruppen för att diskutera resultat och korrigerande åtgärder.
7.3 Genomföra ledningens genomgång (ISO 13485 klausul 5.6)
Uppgift: Planera och genomföra en ledningens genomgång
- Beskrivning: Genomför en ledningens genomgång för att bedöma effektiviteten i QMS och dess anpassning till affärsmålen. Säkerställ att högsta ledningen utvärderar QMS-prestanda och möjligheter till förbättringar.
- Leveranser: Protokoll från ledningens genomgång, handlingsplaner.
- Möte: Presentera resultat och diskutera strategiska förbättringsåtgärder med den högsta ledningen.
Slutlig bedömning: Certifieringsförberedelser och extern revision (Varaktighet: 1 månad)
8.1 Revision före certifiering
Uppgift: Utföra en internrevision före certifiering
- Beskrivning: Genomför en revision före certifiering för att verifiera att QMS uppfyller kraven i ISO 17034:2016 och är redo för certifieringsrevisionen. Åtgärda eventuella återstående avvikelser.
- Leveranser: Revisionsrapport före certifiering, planer för korrigerande åtgärder.
- Möte: Slutlig genomgång med koncernledningen för att bekräfta att vi är redo för den externa revisionen.
8.2 Val av certifieringsorgan och extern revision
Uppgift: Välj certifieringsorgan och schemalägg certifieringsrevisionen
- Beskrivning: Välj ett ackrediterat certifieringsorgan för ISO 13485-revisionen. Samordna schemat för den externa revisionen och se till att organisationen är helt förberedd.
- Leveranser: Rapport om urval av certifieringsorgan, schema för extern revision.
- Möte: Slutmöte med ledningen och kvalitetsteamet för att bekräfta att de är redo för certifieringsrevisionen.
Denna 8-månaders projektplan för Implementering av ISO 13485:2016 ger ett strukturerat tillvägagångssätt för att uppnå certifiering. Planen omfattar nyckelområdena kvalitetsstyrning, riskhantering, design- och utvecklingskontroller, leverantörshantering, avvikelsehantering och interna revisioner, och avslutas med den slutliga certifieringsrevisionen.
Vad våra kunder tycker:
"Vi var till en början överväldigade av tanken på att få ISO 13485-ackreditering, men QSE Academy-paketet gjorde allt så mycket enklare. Dokumenten var välorganiserade och cirka 90% av arbetet var redan gjort åt oss! Vi behövde bara anpassa mindre detaljer, vilket sparade vårt team mycket tid och ansträngning. Vi uppskattade särskilt 1-mot-1-onlinesessionen med ISO-experten, som hjälpte oss att navigera i knepiga delar av ackrediteringen. Det här paketet sparade oss både tid och pengar jämfört med att anlita externa konsulter."
Sarah M.
Compliance Manager
"Att implementera ISO 13485 verkade till en början vara en skrämmande uppgift, men paketet från QSE Academy förändrade allt för oss. Det effektiviserade inte bara hela processen med färdiga mallar och riktlinjer, utan sparade oss också stora kostnader genom att eliminera behovet av heltidskonsulter. Supporten var fantastisk och vi kunde slutföra projektet på en bråkdel av den tid vi ursprungligen beräknade. Rekommenderar detta starkt för alla som letar efter ett kostnadseffektivt sätt att bli ackrediterade!"
James K.
Verksamhetschef
Ofta ställda frågor
Hur lång tid tar det att få det kompletta paketet med dokument efter att jag har gjort min beställning?
När du har slutfört ditt köp kommer du omedelbart att omdirigeras till nedladdningssidan. Dessutom kommer en länk för att komma åt din fil att skickas till din e-post. Filerna tillhandahålls i ett .zip-format, som du måste extrahera. Om du stöter på några problem med nedladdningen, tveka inte att kontakta oss på support@qse-academy.com. Vårt supportteam är alltid redo att hjälpa dig.
Vilka betalningsmetoder kan jag använda?
Vi erbjuder flera betalningsalternativ för att underlätta för dig. Du kan välja att betala med kreditkort, betalkort eller PayPal. Dessutom erbjuder vi en flexibel layaway-plan för dem som föredrar att betala för sitt köp över tid. Om du har några frågor om våra betalningsalternativ, tveka inte att kontakta oss.
Erbjuder ni en pengarna-tillbaka-garanti om jag inte är nöjd med tjänsten?
Vi erbjuder en 30-dagars pengarna-tillbaka-garanti. Om du av någon anledning inte är nöjd med vår tjänst kan du avbryta inom de första 30 dagarna och få full återbetalning, utan att ställa några frågor.
Hur kan jag kommunicera med ISO-experten?
När du gör ett köp kommer du att bli kontaktad av en kundansvarig som hjälper dig genom hela processen. Vår schemaläggning är flexibel för att tillgodose dina behov. När du begär ett möte får du en länk för att välja en tid som fungerar bäst för dig. Dessutom kan du kommunicera med ISO-experten via e-post.






